摘 要:为研究低压静电场结合高湿解冻对羊肉保水性的影响,以宰后成熟24h羊后腿肉为原料,将其置于-18℃冰箱中冷冻24h后解冻,对比分析低压静电场结合高湿解冻(电流0.2mA、电压2 500V、4℃、相对湿度98%)与其他3种解冻方式冰箱解冻(4℃、相对湿度55%)、低压静电场辅助解冻(电流0.2mA、电压2 500V、4℃、相对湿度55%)、高湿解冻(4℃、相对湿度98%)对羊肉解冻速率、保水性、水分分布、羰基含量、总巯基含量、溶解度、表面疏水性,蛋白质二级及三级结构的影响。结果表明:4种解冻方式中,低压静电场结合高湿解冻解冻时间(519min)最短,解冻损失率(3.37%)、蒸煮损失率(30.60%)、羰基含量(3.85nmol/mg)、表面疏水性(21.90μg)最低,不易流动水相对含量(97.96%)与新鲜肉(98.44%)最接近,总巯基含量(28.55nmol/mg)及溶解度(29.98%)最高,且蛋白质二级、三级结构最稳定,说明低压静电场结合高湿解冻不仅能够缩短解冻时间、有效抑制蛋白质氧化变性、减少汁液流失,且经过该处理的羊肉蛋白水合能力最高,保水性最好。
关键词:羊肉;保水性;低压静电场;高湿解冻
冷冻作为肉及肉制品贮藏流通时的一种手段,能够有效抑制肉中微生物生长,延缓生物化学反应,进而延长保质期。而肉及肉制品经过冷冻后再进一步加工前需要进行解冻处理,但解冻过程伴随着物理、化学反应的发生,会导致色泽、质构、风味等肉品质劣变,尤其是解冻后的汁液流失最为严重,肉中的蛋白质会随着解冻汁液流出,不仅造成质量损失,而且造成营养损失,导致经济价值下降。因此冷冻肉的品质不仅取决于冷冻过程还取决于解冻的过程。而选择合适的解冻方式对于维持肉品品质显得尤为重要。目前传统解冻方式如空气解冻、静水解冻、冷藏解冻等,耗时长,解冻后肉品品质劣变严重,新型解冻方式如微波解冻、超声波解冻、高压静电场解等,解冻效率高,能够有效缩短解冻时间,但存在一定局限性。如微波解冻会导致局部过热且蛋白质易于变性;而超声波解冻穿透力差、能耗高;高压静电场解冻则能耗高,且电压过高,存在安全隐患。
近年来,低压静电场辅助解冻由于其安全、节能的优点得到广泛关注。Qian Shuyi等研究了低压静电场辅助解冻对牛肉品质的影响,结果表明低压静电场辅助解冻能够缩短解冻时间,维持牛肉品质。低温高湿解冻效率高、成本低、适用性强,也备受人们的关注。有研究表明高湿解冻能够减少水分流失,并在肉样表面形成水化膜隔绝氧气抑制蛋白氧化。而解冻过程中肌原纤维蛋白氧化则是汁液流失的重要诱因之一。因此选择适宜的解冻方式有利于效缩短解冻时间,抑制蛋白氧化,减少汁液流失,降低解冻成本。而目前国内外对于低压静电场结合高湿解冻对羊肉保水性的研究鲜有报道,本课题组在前期研究中发现低压静电场结合高湿解冻可以有效提高解冻效率,维持肌肉色泽。但对于该解冻条件下羊肉保水性变化机制尚不清楚。因此,本实验以新鲜羊肉作为对照,对比分析了低压静电场结合高湿解冻(4℃,相对湿度为98%)与其他3种解冻方式传统低温解冻(4℃,相对湿度为55%)、高湿解冻(4℃,相对湿度为98%)、低压静电场辅助解冻(4℃,相对湿度为55%)对冷冻羊肉解冻时间、保水性、蛋白质氧化及蛋白构象的影响,为新解冻方式在冷冻羊肉中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
原料肉购自北京北农市场。选取5只6月龄、体质量约60kg唐县育肥带尾羊。羊经放血后采用立式屠宰法进行屠宰,屠宰后于4℃成熟24h,分割完成取5只羊右后腿置于采样箱中冰袋包裹2h内运回实验室。
牛血清白蛋白;氯化钠、磷酸钠、氯化镁、氢氧化钠、三氯乙酸、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH);乙二醇双(2-氨基乙醚)四乙酸(ethylene glycol bis(2-aminoethyl ether)tetraacetic acid,EGTA)、5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis(2-nitrobenzoic acid),DTNB)、溴酚蓝;所有试剂均为分析纯。
1.2 仪器与设备
YC-520L冰箱;DENBAs鲜度保持电场装置;L93-4温度记录仪;NK5500湿度
记录仪;MesoMR23-060H-I低场核磁共振(low field-nuclear magnetic resonance,LFNMR)仪;X-12离心机;TM-18 Basic匀浆机;TENSOR27傅里叶变换红外光谱仪;F-2500荧光分光光度计、U-3010紫外-可见分光光度计。
1.3 方法
1.3.1 原料肉的处理
于室温下剔除肉样表面可见脂肪和结缔组织,分割成约5cm×4cm×2cm、质量(53±5)g的肉块,共50块。从分割好的后腿肉中随机取出10块作为一组装入自封袋中,共分为5组,分别为鲜肉(fresh meat,FM)、冰箱解冻组(refrigerator thawing,RT)(4℃、相对湿度55%),低压静电场辅助解冻组(low voltage electrostatic field assisted thawing,LT)(4℃、相对湿度55%)、高湿解冻组(high humidity thawing,HT)(4℃、相对湿度98%)及低压静电场结合高湿解冻组(low voltage electrostatic field combined with high humidity thawing,LHT)(4℃、相对湿度98%)。将4组肉样置于-18℃冰箱中冷冻24h后解冻,以肉样中心温度达到4℃为解冻终点,进行相应指标的测定。
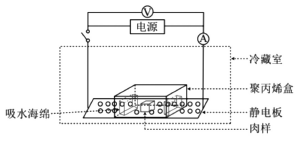
图1 低压静电场结合高湿解冻装置示意图
1.3.2 低压静电场和高湿解冻处理
低压静电场装置由连接静电板(14cm×12cm)的电源和变压器(最大输出电压为2 500V、最大电流0.2mA)组成(图1)。高湿盒由一个可密封的聚丙烯盒子(24cm×16cm×10cm)和2块聚乙烯醇(poly vinyl alcohol,PVA)海绵(11cm×7cm×3cm)组成,2块海绵均吸收45mL蒸馏水后置于高湿盒两侧,并将未吸水海绵同样置于聚丙烯盒两侧作为低湿盒。所有解冻实验均在4℃冰箱中进行,每个处理2个解冻盒,每个盒中放置5块肉样。RT组和LT组肉样均放于低湿盒中加盖密封解冻,并将LT组放在静电板上;HT组和LHT组肉样均放于高湿盒中加盖密封解冻,并将LHT组放在静电板上。
1.3.3 解冻时间的测定
设定温度记录仪参数,每隔1min测定一次,在肉样冷冻前将温度记录仪插入肉样中心部位,解冻时开启温度记录仪,解冻完成用LOGGER 1.8.2软件获取数据,绘制温度变化曲线。
1.3.4 解冻损失率的测定
分别称取贮藏前肉样质量(m0/g)、解冻后肉样质量(m1/g),称质量前先用吸水纸擦干肉样表面水分。解冻损失率按式(1)计算。
1.3.5 蒸煮损失率的测定
将解冻后的肉样修剪成约4cm×3cm×2cm大小,在72℃水浴锅中蒸煮30min,随后冷水冷却至室温。分别称取蒸煮前质量(m2/g)和蒸煮后质量(m3/g)。蒸煮损失率按照公式(2)计算。
1.3.6 离心损失率的测定
将解冻后肉样切成约2.7g大小,用滤纸包裹置于10mL离心管中,在4℃条件下2 000×g离心15min。分别称取离心前质量(m4/g)和离心后质量(m5/g)。离心损失率按照式(3)计算。
1.3.7 水分分布和氢质子成像分析
水分分布和氢质子密度成像参照谢小雷等的方法稍作修改。将解冻后的肉样品切成4cm×3cm×2cm的肉块,设置核磁共振的参数:主频为23MHz、偏移频率为286.781 3kHz、90°脉冲时间为17μs、180°脉冲时间为35μs、采样点数54 996、重复时间3 000ms、累加次数4次、回波数2 000。将样品放入直径为60mm的检测管中,采用核磁共振成像系统自旋回波成像序列对肉样进行氢质子密度成像测定,参数设置为:重复时间2 000ms、重复次数4次、纵向弛豫时间20ms,根据CPMG序列测得的弛豫时间T2,选择自旋回波时间20ms。
1.3.8 羊肉肌原纤维蛋白的提取
参考Li Yin等的方法进行肉样肌原纤维蛋白的提取,提取的肌原纤维蛋白置于4℃冰箱内备用。双缩脲法进行蛋白质量浓度的测定,并用磷酸盐缓冲液(20mmol/L Na2HPO4、0.6mol/L NaCl,pH6.0,下同)稀释蛋白。
1.3.9 蛋白质羰基和总巯基含量测定
参考Zhang Bin等等的方法测定羰基含量。各取2份1mL 2mg/mL的肌原纤维蛋白溶液置于10mL离心管中,一份加入lmL 10mmol/L DNPH;另一份加入1mL2mol/L HCl溶液作为对照组。在室温下避光静置1h,期间每隔15min振摇一次,振摇1min。随后加入1mL20g/100mL 三氯乙酸(trichloroacetic acid,TCA)沉淀蛋白15min,并在4℃下10 000×g离心5min,弃去上清液,随后用1mL体积比为1∶1的乙酸乙酯-乙醇溶液充分洗涤重复3次。所得沉淀用3mL 6mol/L盐酸胍溶液溶解,37℃条件下水浴保温15min。随后10 000×g离心5min,取上清液在370nm波长处测定吸光度。蛋白质羰基含量按公式(4)计算。
式中:ρ为肌原纤维蛋白质量浓度(2mg/mL)。
总巯基含量的测定参照Cui Chun等的方法。取1mL 2mg/mL肌原纤维蛋白溶液与8mL的Tris-甘氨酸缓冲液(0.086mol/L Tris、0.09mol/L甘氨酸、4mmol/LEDTA、8mol/L尿素,pH8.00)混匀,10 000×g离心15min。然后取4.5mL上清液,加入0.5mL 10mmol/LDTNB溶液,涡旋30s,室温(25±1)℃下静置30min,使用酶标仪于412nm波长处测吸光度。以4.5mL Tris-甘氨酸缓冲液代替上清液作为空白对照,总巯基含量按照公式(5)计算。
式中:ε表示摩尔吸光系数(1.36×104L/(mol·cm);D为稀释倍数(10);ρ为肌原纤维蛋白质量浓度(2mg/mL)。
1.3.10 溶解度和表面疏水性的测定
取5mL 2mg/mL的肌原纤维蛋白溶液于10mL离心管中,在4℃条件下10 000×g离心15min,用双缩脲法测定上清液蛋白质量浓度。蛋白质溶解度根据公式(6)计算。
肌原纤维蛋白表面疏水性的测定参考Chelh等的方法。取1mL2mg/mL肌原纤维蛋白溶液与200μL 1mg/mL的溴酚蓝溶液混合均匀。对照组采用1 mL磷酸盐缓冲液(不加蛋白)与溴酚蓝溶液混合。将混合液在室温下振荡15min,随后室温下4 000×g离心15min。上清液用蒸馏水稀释10倍,以磷酸盐缓冲液为空白,在595nm波长处测定上清液光密度值(OD)。用结合态的疏水溴酚蓝结合量(总溴酚蓝与游离溴酚蓝的差值)表征表面疏水性指数,蛋白质表面疏水性根据公式(7)计算。
1.3.11 傅里叶变换红外光谱测定
参照Gangidi等的方法略作修改。采用傅里叶变换红光谱仪分析蛋白质二级结构的组成,取20μL(2mg/mL)肌原纤维蛋白溶液置于衰减全反射(attenuated totalreflectance,ATR)-FTIR附件上扫描。测定条件:光谱扫描范围为4 000~600cm-1,分辨率为4cm-1,信号扫描累加64次,扫描速率为0.63cm/s,每种处理图谱扫描重复3次。采用Peakfit 4.12软件分析1 600~1 700cm-1波段的峰,利用二阶求导和去卷曲对酰胺Ⅰ带进行分峰处理,再结合曲线拟合的方法对蛋白质二级结构进行定量分析。
1.3.12 内源荧光光谱测定
参考Wang Zhaoming等的方法略作修改。用F-2500荧光分光光度计测定肌原纤维蛋白溶液(0.5mg/mL)的色氨酸荧光光谱。参数设置为:激发波长295nm狭缝宽度均为10nm、发射光谱范围300~400nm。并以磷酸盐缓冲液(20mmol/L Na2HPO4、0.6mol/L NaCl,pH6.0)作为空白对照进行测定。
1.3.13 紫外二阶导数光谱测定
参考Wang Zhaoming等的方法并略作修改。肌原纤维蛋白溶液稀释至0.5mg/mL,用稀释液作为空白,置于U-3010紫外-可见分光光度计中测定紫外吸收光谱,波长扫描范围为230~320nm,扫描速率为240nm/min。
1.4 数据处理与分析
实验数据利用SPSS Statistics 26软件进行方差分析,并使用Duncan法多重比较进行差异显著性分析(P<0.05)。采用Origin 2021软件绘图,结果以3次平行测定结果的平均值±标准差表示。
2 结果与分析
2.1 不同解冻方式对冷冻羊肉解冻时间的影响
解冻过程伴随着物理化学反应,导致肉品品质劣变,因此解冻时间对肉及肉制品品质具有重要影响。不同解冻方式下冷冻羊肉中心温度变化如图2所示。RT、LT、HT、LHT解冻时间分别为1 329、803、799、519min,LHT组解冻时间最短,RT组解冻时间最长,表明低压静电场与高湿解冻相结合能够有效缩短解冻时间。4种解冻处理组中静电场解冻组LT和LHT组分别比非静电场解冻组RT和HT组解冻时间缩短。这与Qian Shuyi等研究结果相似,静电场解冻时间较短可能是因为电场存在下电极周围产生的离子被加速,由此产生的动量从空气中的离子转移到中性空气分子中,并形成电晕风,而分散的流体被转移到表面,在边界层上形成湍流,增加了传热系数。而高湿解冻组HT和LHT组则分别比非高湿解冻组RT和LT组解冻时间短,这可能是因为高湿条件下水蒸气冷凝释放大量潜热,并在肉样表面形成一层水化膜,传热速率提升。朱明明等也研究了不同高湿解冻条件下解冻对猪肉品质的影响,发现随着环境相对湿度的增加,解冻时间缩短,解冻效率提高。
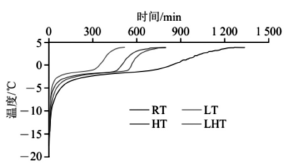
图2 不同解冻方式下冷冻羊肉的中心温度变化曲线
2.2 不同解冻方式对羊肉持水性的影响
持水性是肉品最重要的品质特性之一,较差的持水性不仅会导致较高的汁液流失,还伴随着大量的肌浆蛋白和其他水溶性营养物质流失,最终导致肉品营养价值下降。而解冻损失率、蒸煮损失率、离心损失率等常用来表征肉品持水性高低。不同解冻方式对羊肉的持水性影响如表1所示。LT、HT和LHT组解冻损失率分别为3.73%、4.90%和3.37%,显著低于RT组(6.71%)(P<0.05)。可能是因为RT的解冻时间过长,蛋白质氧化严重,氧化使得蛋白质去折叠结构发生变化,蛋白水结合能力降低。LHT组解冻损失率最低,且显著低于HT组(P<0.05)。可能是在高湿环境下肉样表面形成的水膜维持了肌细胞的完整性和保水性,同时低压静电场辅助解冻有效减少了肌肉水分流失,改善了羊肉品质。
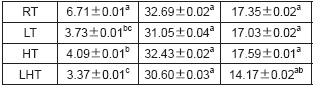
注:同列肩标小写字母不同表示差异显著(P<0.05)。下同。
不同解冻方式也会造成肉样蒸煮损失、离心损失发生不同程度变化。经过解冻后的肉样蒸煮损失率和离心损失率较新鲜肉总体显著增加(P<0.05),各解冻组间蒸煮损失率和离心损失率无显著差异(P>0.05)。其中,LHT组蒸煮损失率和离心损失率均最低,分别为30.60%、14.17%,且离心损失率与鲜肉(13.36%)差异不显著(P>0.05),这与解冻损失率结果相一致。表明低压静电场结合高湿解冻有效提高解冻后肉样的保水能力。
2.3 不同解冻方式对羊肉T2弛豫时间、水分分布和氢质子密度的影响
通过LF-NMR测定的T2可反映肉样中水分的迁移和流动性。图3A中可观察到代表3种不同水分的峰,分别是弛豫时间为0.1~10ms的结合水(T2b)、10~100ms处分布在肌纤维网中的不易流动水(T21)和100~1 000ms处的自由水(T22)。各组T2b没有明显差异,而不同解冻方式下T21延长,表明经过解冻可能会使得水分流动性增强。图3B为不同解冻方式下肉样中结合水、不易流动水和自由水相对相对含量图。解冻后结合水相对含量上升,且LHT组结合水相对含量最低,RT组结合水相对含量最高,这可能是因为之前冻结过程中形成的冰晶在一定程度上破坏了肌肉组织结构。就不易流动水而言,鲜肉相对含量最高(98.44%),而解冻后不易流动水相对含量下降,其中相较于其他解冻组,LHT组相对含量最高(97.96%),另外,观察到解冻后自由水相对含量上升,表明解冻后水分发生迁移,部分不易流动水态变为自由水,且自由水含量越高表明肉样保水性越差。Cao Minjie等也报道了类似的结果。这可能是因为肉样解冻过程中蛋白质氧化造成蛋白质去折叠,蛋白结构展开,内部疏水性氨基酸暴露,表面疏水性上升,蛋白与水结合能力下降,冰晶融化后的部分不易流动水无法再与变性蛋白结合而发生迁移流到细胞外,转变为了自由水。而RT组不易流动水相对含量最低、自由水相对含量最高,而LHT组则正相反,这也与保水性结果一致。
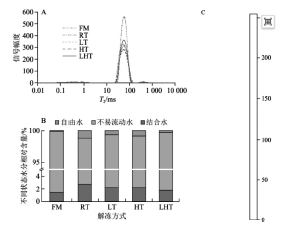
图3 不同解冻方式对羊肉弛豫时间(A)、水分分布(B)和氢质子成像(C)的影响
氢质子密度可用来反映肉样的含水率。图像越红则代表氢质子密度越高,含水率也越高,图像越蓝则表示氢质子密度越低,含水率越低。不同解冻方式下氢质子密度如图3C所示,鲜肉图像大部分为红色,表明含水率高。RT组解冻后红色少,含水率低。而LHT组解冻红色区域较多含水率高。这与持水性分析结果一致。
2.4 不同解冻方式对羊肉羰基含量、总巯基含量、溶解度及溴酚蓝结合量的影响
蛋白质羰基衍生物含量是衡量蛋白质氧化程度的最常用指标之一,羰基含量越高则表明蛋白氧化程度越高。不同解冻方式对羊肉羰基含量如表2所示。RT、LT、HT组肉样的羰基含量显著高于鲜肉羰基含量(P<0.05),表明解冻会使得羰基含量上升。羰基含量上升将会导致蛋白质交联而影响蛋白质结构,最终导致肌肉保水性下降。LHT组羰基含量最低(3.85nmol/mg),与鲜肉(3.48nmol/mg)差异不显著(P>0.05),表明LHT能够有效抑制蛋白质氧化。而RT组羰基含量最高,蛋白质氧化最为严重,这可能与其解冻时间过长有关。长时间解冻可能导致了RT肉样蛋白氧化、变性剧烈,蛋白构象发生变化,进而导致其蛋白水合能力下降,持水性变差。HT组羰基含量与LT组差异不显著(P>0.05),这说明HT可能与LT抑制蛋白羰基化的效果接近。
巯基是决定蛋白质功能性质的重要基团,总巯基含量越高,蛋白氧化程度越低。不同解冻方式对羊肉总巯基含量的影响如表2所示。与FM组(29.41nmol/mg)相比,RT(24.88nmol/mg)、LT(27.57 nmol/mg)、HT(26.96nmol/mg)、LHT(28.55 nmol/mg)组总巯基含量分别减少了15.4%、6.3%、8.3%、2.9%,表明解冻会使总巯基含量降低。总巯基含量减少意味着二硫键的生成。而生成的二硫键将导致肌原纤维蛋白交联聚集,并且使蛋白质结构的完整性遭到破坏。4种解冻处理组中,LHT组样品总巯基含量较其他解冻方式最高,且与鲜肉差异不显著(P>005),其次是LT组,这可能是因为静电场抑制了自由基介导的肌原纤维蛋白氧化。HT组总巯基含量则略低于LT组,且二者差异不显著(P>0.05)。RT组则由于解冻时间过长总巯基含量最低,且显著低于其他解冻组(P<0.05)。
溶解度反映了肌原纤维蛋白变性的程度,溶解度越低变性程度越高。不同解冻方式下肌原纤维蛋白溶解度变化如表2所示。相比于FM组,经过解冻后肉样溶解度降低。这可能是解冻过程中蛋白质氧化使得蛋白质分子聚集导致。其中LHT组溶解度(29.98%)与FM组(32.83%)差异不显著(P>0.05),且显著高于其他解冻处理组(P<0.05)。说明因电场和高湿环境,LTH有效抑制了蛋白氧化,维持了蛋白质构象,具有较高的蛋白质溶解度。RT组溶解度(18.91%)最低,并且显著低于其他解冻组(P<0.05),表明RT组蛋白质变性最为严重。这与羰基和总巯基含量测定结果相一致。可能是RT组长时间解冻导致了蛋白质羰基含量和疏水基团数目增加,蛋白质结构破坏,蛋白质间发生交联,引起蛋白质溶解度下降。
蛋白质表面疏水性可作为评价蛋白质分子表面疏水性氨基酸相对含量和蛋白质变性程度的指标。不同解冻方式对表面疏水性的影响如表2所示。与FM组(18.54μg)相比,RT组(30.07μg)、LT组(23.68μg)、HT组(24.68μg)表面疏水性显著升高(P<0.05)。表明解冻会导致疏水性残基暴露进而降低蛋白与水结合能力。这可能是因为解冻过程中氧化诱导蛋白质构象展开,暴露出原先包埋在内部的疏水性氨基酸。LHT组(21.90μg)表面疏水性与FM组差异不显著(P>0.05),表明LHT能够有效抑制蛋白质变性,维持蛋白质结构。而RT组表面疏水性显著高于其他解冻组(P<0.05),蛋白质变性最严重。
2.5 不同解冻方式对羊肉肌原纤维蛋白二级结构的影响
酰胺I区谱带(1 600~1 700 cm-1)常被用来估计蛋白质二级结构。不同解冻方式对蛋白质二级结构相对含量的影响如图4所示。α-螺旋通常代表蛋白质稳定的结构,无规卷曲则表示蛋白质无序的结构。FM组α-螺旋相对含量为40.42%,无规卷曲相对含量为15.48%,RT、LT、HT、LHT组α-螺旋相对含量分别为28.37%、34.99%、32.18%、37.79%,而无规卷曲相对含量分别为25.87%、22.32%、20.95%、15.54%,经过不同方式解冻后肉样α-螺旋相对含量降低,无规卷曲相对含量上升。
这与Bozzato等报道一致,解冻过程中蛋白质氧化破坏了维持二级结构稳定性的氢键,导致α-螺旋相对含量降低。而α-螺旋相对含量降低、无规卷曲相对含量上升说明蛋白质发生变性,并且影响肌肉持水性。4种解冻处理组中,RT组α-螺旋相对含量最低,而LHT组相对含量最高,表明RT组蛋白质结构破坏严重,LHT则能有效维持蛋白质结构。
图4 不同解冻方式对羊肉肌原纤维蛋白二级结构的影响
2.6 不同解冻方式对羊肉肌原纤维蛋白内源荧光强度的影响
内源荧光光谱可反映蛋白质三级结构色氨酸残基微观环境极性变化。不同解冻方式对肌原纤维蛋白内源荧光强度的影响如图5所示。相比于FM组,不同解冻方式下肌原纤维蛋白最大内源荧光强度均降低,表明经过解冻后蛋白质三级结构解折叠。Wang Bo等也报道了类似的结果,解冻处理会导致猪肉肌原纤维蛋白内源荧光强度降低。在4种解冻处理组中,LHT组内源荧光强度最高,可能是经过LHT处理的肌原纤维蛋白解折叠程度较低,只有少数位于蛋白质中心的色氨酸残基暴露在极性溶剂环境中。而RT组由于过度的蛋白氧化促进了蛋白质结构展开,导致其内源荧光强度最低。通过分析最大发射波长(λmax)的位移可以判断色氨酸残基微环境变化。FM组λmax位于334nm处,表明色氨酸残基位于疏水性环境中。其他4种解冻处理组中只有RT组λmax发生红移(向长波方向移动至335nm),表明经过RT处理后蛋白解折叠,致使埋藏在蛋白结构中的色氨酸残基暴露在极性溶剂中。
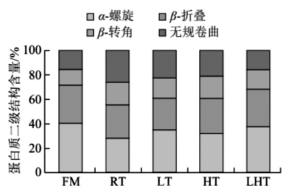
图 5 不同解冻方式对羊肉肌原纤维蛋白内源荧光强度的影响
2.7 不同解冻方式对羊肉肌原纤维蛋白紫外光谱的影响
紫外二阶导光谱可用于解析蛋白质的构象变化。不同解冻方式对肌原纤维蛋白紫外二阶导光谱的影响如图6所示。FM组在288nm和296nm处出现波峰,在284nm和291nm处出现波谷。288nm处的波峰由酪氨酸和色氨酸残基共同作用,而296nm处波峰仅归属于色氨酸残基。与FM组相比,不同解冻组的288nm处波峰发生蓝移(向短波方向移动),酪氨酸和色氨酸微观环境极性增加导致蛋白质三级结构展开,增加了表面疏水性。RT、HT组在296nm处波峰红移(向长波方向移动),说明蛋白质构象展开,并且疏水性氨基酸残基暴露至蛋白表面。两个波峰与波谷之间距离比值r=a/b(振幅比)能够反映出酪氨酸极性和蛋白质结构展开变化。对于酪氨酸,其r值随着溶剂极性的降低而减小,而对于色氨酸,其r值几乎不依赖于溶剂极性。相比于FM组样品,RT、LT、HT、LHT组样品的r值分别增加至1.44、1.38、1.38、1.35,说明由于蛋白质结构展开,埋藏在蛋白质内部疏水环境中的酪氨酸暴露在蛋白质表面极性区域中。这与Zhao Juyang等的研究结果一致,说明经过解冻后,由于蛋白质构象展开使得埋藏在蛋白质内部疏水环境中的色氨酸和酪氨酸残基暴露在蛋白质表面极性区域中。这与本研究中的内源荧光光谱分析结果一致。
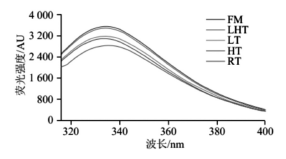
图 6 不同解冻方式对羊肉肌原纤维蛋白紫外二阶导光谱的影响
2.8 相关性分析
不同解冻方式下羊肉理化指标的相关性如图7所示。解冻时间与解冻损失率、羰基含量、表面疏水性、r值呈极显著正相关(P<0.01),与自由水、无规卷曲相对含量呈显著正相关(P<0.05),与总巯基含量、溶解度、α-螺旋相对含量呈极显著负相关(P<0.01),与内源荧光强度呈显著负相关(P<0.05);解冻损失率与自由水相对含量、羰基含量呈显著正相关(P<0.05),与总巯基含量、溶解度、α-螺旋相对含量、荧光强度、不易流动水相对含量呈显著负相关(P<0.05),与表面疏水性、r值呈极显著正相关(P<0.01);自由水相对含量与羰基含量、表面疏水性呈极显著正相关(P<0.01),与总巯基含量、溶解度、α-螺旋相对含量、不易流动水相对含量呈极显著负相关(P<0.01);羰基含量、总巯基含量变化对溶解度、表面疏水性及蛋白质构象均有显著或极显著影响。由相关性分析可知,随着解冻时间延长,蛋白质氧化程度加深,蛋白构象的完整性遭到破坏,与水结合能力下降,解冻后部分不易流动水无法与变性蛋白相结合而发生迁移至细胞外空间“态变”为自由水,导致解冻后汁液流失增加。

*.显著相关(P<0.05);**.极显著相关(P<0.01)。
图7 冷冻羊肉解冻特性与解冻后品质的相关性分析
3 结 论
通过对不同解冻方式下羊肉持水性表征及与肌肉持水性相关的蛋白特性分析,明确了与RT处理相比,LT、HT、LHT 3种解冻方式均能缩短解冻时间,抑制蛋白质氧化变性,维持蛋白质构象,延缓水分迁移,并减少汁液流失,且LHT处理维持解冻后羊肉持水性的效果最好。因此,低压静电场结合高湿解冻能够作为一种有效减少羊肉解冻过程中汁液流失的方法。








