摘要:以猪背最长肌为原料,研究超高压(100~600MPa)结合热处理(25~55℃)条件下,蛋白质相互作用力的变化,猪肉主要组成部分肌原纤维蛋白氧化程度,表面疏水性及结构变化,并建立他们之间的相关性。研究结果表明:超高压结合热处理后稳定猪肉蛋白质的作用力主要是氢键、疏水性相互作用和二硫键。经超高压结合热处理的肌原纤维蛋白质巯基含量极显著下降(p<0.01),二硫键含量、疏水性和羰基值极显著上升(p<0.01)。二级结构发生重排,螺旋结构减少,无序结构增多。相关性分析结果表明超高压结合热处理与蛋白质相互作用力、蛋白质羰基值、蛋白质结构之间存在着极显著的相关关系(p<0.01)。这些结果可以帮助我们全面认识超高压结合热处理过程中蛋白质的变化,科学指导其生产过程,为开发新型肉制品提供理论依据。
关键词:超高压;热处理;蛋白质相互作用力;蛋白质结构;相关分析
食品超高压技术能在不影响肉类风味和营养成分的前提下改善肉类嫩度,延长货架期,同时保持原有的色、香、味、形,但同时超高压处理也能促进肉中脂肪氧化,这也限制了其在肉制品中的应用。大量研究表明,对僵直前期的肌肉进行压力处理能取得较好的嫩化效果,而僵直后肌肉则需与一定的热处理相结合。因此,高压技术在肉类加工中的应用正朝着与热结合处理的方向发展。我国超高压技术的研究明显落后于发达国家,尤其是日本、美国和韩国等,迫切需要加快开展超高压食品的研究。
蛋白质是肉制品的主要组成部分之一,肌原纤维蛋白约占总蛋白的40%~60%,不但在肌肉收缩中很重要,而且在肉类加工中起关键作用,它与肉制品加热过程中形成的粘结性和质构有关,还赋予肌肉食品许多期望的物理化学特性,具有重要的生物学功能特性,对食品感官品质具有重要的影响。超高压结合热处理会改变蛋白质相互作用力及结构,使其功能特性发生变化,如蛋白质的溶解性、凝胶型及乳化活性等,从而影响实际生产中蛋白质的加工特性和营养价值。只有了解超高压结合热处理过程中蛋白质结构变化机制,才能更好地在实际生产中进行规模化应用。
近年来,高压对蛋白质的影响逐渐成为食品工作者研究的热点,在高压条件下蛋白质结构的变化是高压技术在食品中应用的基础。目前,相关研究主要集中在肌原纤维蛋白及其主要成分肌球蛋白的热诱导凝胶特性和单纯高压处理对于蛋白质结构及凝胶特性的影响。国内外尚未见超高压结合热处理对猪肉蛋白质相互作用力及结构影响的报道。本研究以猪背最长肌为原料,对其进行超高压(100~600MPa)结合热(25~55℃)处理15min,利用不同溶剂对不同蛋白质作用力的规避作用研究蛋白质相互作用力的变化,评价猪肉主要组成部分肌原纤维蛋白氧化程度,跟踪其表面疏水性及结构的变化,并分析他们之间的相关性,以期全面认识超高压结合热处理过程中蛋白质的变化,加快超高压食品的研究,科学指导其生产过程,为开发新型肉制品提供理论依据。
1 材料与方法
1.1 材料与仪器
白玉黑土猪 四川绵阳天农生态食品开发有限公司提供,为同批饲养,宰杀后冷却,取背最长肌约1kg,快速运回实验室,剔除肉眼可见脂肪及结缔组织等,按20g/份分装于真空透明封装袋中,于真空封装机上真空包装,-18℃保藏待用。原料肉使用前需在4℃下解冻24h。
苯甲基磺酰氟;磷酸氢二钠、磷酸二氢钠、盐酸、EDTA、三氯乙酸(TCA)、氯化钠、尿素、溴酚蓝、乙酸、十二烷基磺酸钠(SDS)、三羟甲基氨基甲烷(Tris)、β-巯基乙醇、丙酮、乙酸乙酯、盐酸胍及其他常规化学试剂均为分析纯。
HPP.L2-800/1型食品高压设备;DZ400-DZ(2L)型真空封装机;FSH-2A可调高速匀浆机;UV1000型紫外可见分光光度计;CR22GⅢ高速冷冻离心机 HITACHI;FT-IR5700 傅里叶变换红外光谱仪。
1.2 超高压结合热处理
超高压结合热处理参数设置为:最高工作压力为800MPa,升压速度约50MPa/s,卸压速度约100MPa/s。传压介质为葵二酸二辛酯液压油,将真空封装且解冻后的样品,对其进行超高压(100~600MPa)结合热处理(25~55℃)15min。处理后备用。
1.3 猪肉蛋白质分子相互作用力的测定
猪肉蛋白质分子相互作用力的测定参照Visessanguan 等方法,并略加改进。溶液包括:0.6mol/L KCl (S1);20mmol/L Tris,pH8.0 (S2);20mmol/LTris,pH8.0包含1% (m/V) SDS (S3);20mmol/L Tris,pH8.0包含1% (m/V) SDS 和8mol/L 尿素(S4);20mmol/L Tris,pH8.0包含1% (m/V) SDS,8mol/L 尿素和2% (V/V)β-巯基乙醇(S5);0.5 mol/L NaOH(S6)。2g绞碎样品,分别加入20mL上述溶液,室温下磁力搅拌4h,其S5搅拌前100℃水浴2min。样品在离心机中以12100×g离心30min,将4mL上清液加入50% TCA使上清液最终TCA浓度达到10%,样品在3℃冷藏18h,之后在离心机中以2500×g离心20min,沉淀用0.5mol/L NaOH 溶解,蛋白质含量采用双缩脲法测定。结果以各部分蛋白含量占S6的百分比表示。
1.4 猪肉肌原纤维蛋白的分离与检测
采用Martinaud 等方法并略加改进。10g绞碎样品,加入10倍溶液(20mmol/L磷酸盐缓冲溶液,pH6.5,含50mmol/L NaCl,25mmol/L KCl,3 mmol/LMgCl2,4 mmol/L EDTA,1mmol/L PMSF),用高速匀浆机在8000r/min 冰浴下均质1min,匀浆过60目筛网去除基质蛋白,滤过液在冷冻离心机中离心(2000×g,15min,4℃),沉淀部分用50mmol/L KCl(pH6.4)磷酸盐缓冲液洗涤一次和去离子水洗涤两次。得到沉淀即为肌原纤维蛋白。部分样品冷冻干燥备红外光谱检测。
1.4.1 肌原纤维蛋白巯基和二硫键含量的测定
参照Beveridge 等的Ellman 试剂分析方法略加改进。加4mg DTNB 试剂于1mL的Tris-甘氨酸缓冲液(0.086 mol/L Tris,0.09 mol/L甘氨酸,4 mmol/LEDTA,pH8.0)中,配成Ellman 试剂。将提取的肌原纤维蛋白加入5倍体积的缓冲溶液匀浆,取0.5mL匀浆液溶于2.5 mL的Tris-甘氨酸-8mol/L尿素缓冲液,漩涡震荡,加入20μL Ellman 试剂,将悬浊液置于室温(25℃±1℃)下保温1h,10000×g离心15min,测定412nm处吸光值(A412),以牛血清白蛋白为标准,280nm测定相应蛋白质含量。计算公式如下:
μmol SH/g=73.53A412/C
其中73.53=106/1.36×104,1.36×104为摩尔消光系数,C 为样品的蛋白质浓度,mg/mL。
测定总巯基含量时,取0.2 mL匀浆液,加入2mLTris-甘氨酸-10mol/L尿素缓冲液,再加入0.02 mL β-巯基乙醇,室温下反应1h,之后加入50%TCA至最终浓度为10%,3000×g离心沉淀用12%TCA 洗涤两次,将沉淀溶于3mL的Tris-甘氨酸-8mol/L 尿素缓冲液,二硫键含量为总巯基含量与游离巯基的差值。
1.4.2 肌原纤维蛋白羰基值的测定
蛋白质的氧化采用羰基值表征。测定方法按照Oliver等方法。
1.4.3 肌原纤维蛋白表面疏水性的测定
肌原纤维蛋白用20mM的磷酸缓冲溶液分散,用双缩脲法调整蛋白浓度为10mg/mL。表面疏水性测定采用Chelh等方法并略加改进,1mL悬浊液加入40μL 1mg/mL的溴酚蓝溶液,涡旋振荡混匀10min。空白为用20mM的磷酸缓冲溶液代替蛋白溶液。在离心机中以2000×g离心15 min,595nm测定吸光值。表面疏水性按下述公式计算:
BPB bound(μg)=40μL×(OD control-OD sample)/OD control
1.4.4 肌原纤维蛋白二级结构的测定
采用傅里叶红外变换光谱(FT-IR)分析肌原纤维蛋白的二级结构。准确称量2mg的样品,加入100mg溴化钾,用研钵研磨成均匀粉末,压制成薄片,再用红外光谱仪做全波段扫描(400~4000 cm-1),扫描次数128次。数据处理采用PeakFit 4.12软件,Omnic 软件和Origin8.0软件。
1.5 数据分析
每组试验重复4次,所有数据均以平均值±标准差(X±SD)给出,采用SPSS 11.5统计分析软件进行数据分析(p<0.01)。
2 结果与分析
2.1 超高压结合热处理对猪肉蛋白质相互作用力的影响
影响蛋白质折叠的作用力主要可以分为两类:蛋白质分子固有作用力所形成的分子内相互作用;受周围溶剂影响的分子内相互作用。范德华相互作用和空间相互作用属于前者,而氢键、静电相互作用和疏水相互作用属于后者。在超高压结合热处理过程中,猪肉蛋白质分子间相互作用力会发生改变,进而影响其品质和加工性能。
本研究采用五种不同的溶剂规避不同的蛋白质作用力,氯化钾规避静电作用力,SDS规避氢键,尿素规避疏水作用力,巯基乙醇打破二硫键。图1(a~e)显示了猪肉经超高压(100~600 MPa)结合热处理(25~55℃)后,蛋白质在不同溶剂(S1~S5)中溶解度的变化,进而反映出不同的蛋白质分子相互作用力在超高压结合热处理过程中的变化规律,从而得出其对三维结构的贡献。
随着处理压力和温度的升高,蛋白质在S1中的溶解度呈现下降趋势,主要是由于热作用导致蛋白质变性和蛋白质降解所造成的蛋白质部分损失。增加处理压力,蛋白质之间的静电相互作用被削弱,符合勒夏特列原理,即超高压会促进蛋白质分子内的离子键断裂。S2的变化规律与S1类似,超高压和热处理会造成蛋白质多肽链伸展和去折叠从而形成一些网络结构,使蛋白质天然结构发生改变,导致蛋白质变性和聚集,影响蛋白质在S2中的溶解度。在25℃下,随着压力的增大,蛋白质在S3中的溶解度变化并不明显。温度进一步升高到35℃,在不同的压力处理条件下,溶解度略有下降。温度继续从35℃增加到55℃,常压下溶解度明显变化(从63.90%下降到55.93%),然后随着压力的上升,又逐步回升。原因可能在于,温度从35℃增加到55℃,蛋白质在热作用下二级结构被破坏,氢键急剧减少;然而超高压处理可以增强蛋白质分子间的氢键,Le Tilly 等人对马心肌肌红蛋白进行了红外光谱分析,发现300MPa的压力对分子内部的氢键有稳定作用。随着压力的升高,蛋白质形成新的稳定结构,相应的氢键作用力又缓慢回升。温度从25℃升到35℃,常压下蛋白质在S4中的溶解度减小,温度进一步升高到55℃,溶解度达到最大值。然后随压力的增大而逐步回落。蛋白质溶液系统中的熵增加是疏水作用的主要推动力。从35℃到55℃,热作用使得蛋白质溶液变性展开,疏水基团更加暴露,疏水相互作用力也快速升高。这时增加处理压力,蛋白质凝胶网络逐步形成和加强,疏水基团被不断固定,因此疏水相互作用力稳步下降。Grigera 等人研究发现,300MPa的压力降低了脱辅基肌红蛋白的疏水作用,引起该蛋白分子三维结构的改变。蛋白质在S5中的溶解度随着压力和温度的升高而增大,55℃600MPa达到最大值。这是因为,随着压力和温度的增加,蛋白质结构展开,暴露的巯基通过二硫键形成聚集。
综上所述,超高压结合热处理后稳定猪肉蛋白质的作用力主要是氢键、疏水性相互作用和二硫键。未处理猪肉在S1-S5溶剂中溶解度从大至小分别为S3>S4>S5>S2>S1,说明此时静电作用、氢键、疏水作用和二硫键均对蛋白三维结构有贡献,而超高压结合热处理后,改变了这几种作用力的贡献大小,使得溶解度大小变化为S5>S3>S4>S2>S1,表明在超高压结合热处理的过程中,蛋白质降解会导致肉蛋白中巯基的暴露,加快二硫键的形成,而二硫键对于蛋白质三维结构的稳定起着重要作用。
2.2 超高压结合热处理对猪肉肌原纤维蛋白巯基和二硫键的影响
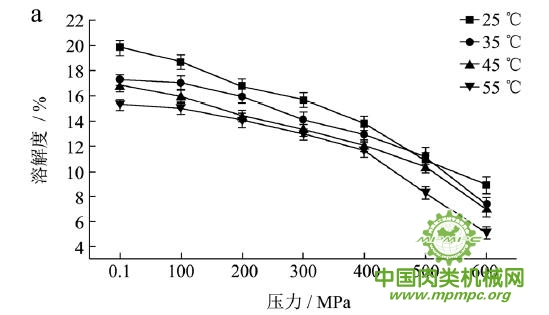
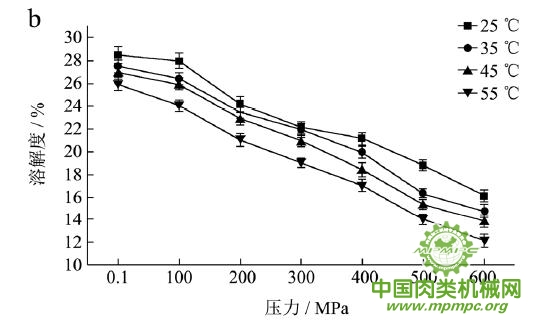
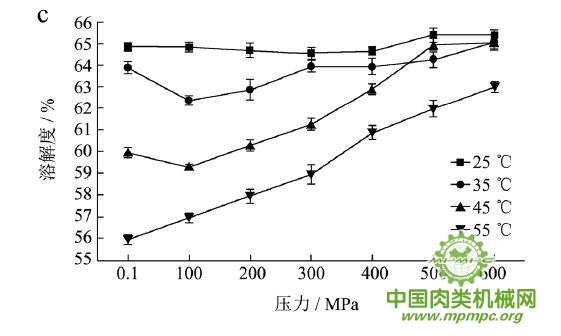
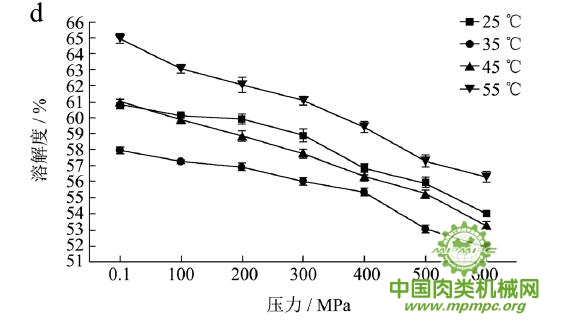
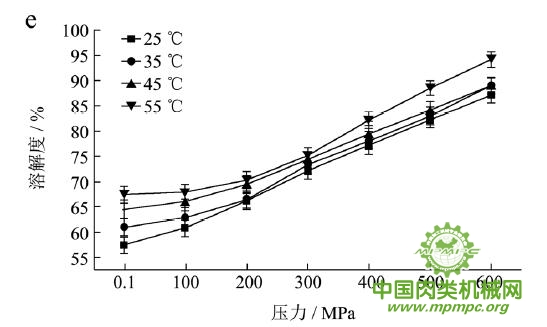
图1 超高压结合热处理对蛋白质相互作用力的影响
注:a~e分别代表不同温度和压力处理条件下,蛋白质在溶剂S1~S5中的溶解性。
天然蛋白质中包埋有许多疏水基团和疏基,图2为超高压结合热处理条件下猪肉肌原纤维蛋白疏基和二硫键含量的变化情况。从图中可以看出,随着压力和温度的上升,巯基含量极显著下降(p<0.01),二硫键含量极显著上升(p<0.01)。这表明超高压和热处理下巯基基团暴露到分子表面,部分与空气中的氧气充分结合,形成二硫键,与2.1中超高压结合热处理过程中二硫键对于蛋白质三维结构的稳定起着重要作用结果一致。二硫键是稳定蛋白质结构的重要化学键,二硫键的生成可以降低蛋白质的构象熵,使蛋白质结构变得稳定从而达到良好的热稳定性,蛋白质网络结构也更为致密,凝胶强度增加。因此,肉制品超高压处理应充分考虑压力和温度对蛋白质结构的影响。
2.3 超高压结合热处理对猪肉肌原纤维蛋白疏水性的影响
肌原纤维蛋白质属于水不溶性蛋白,不能采用ANS荧光探针法测定,Chelh利用疏水性基团与溴酚蓝结合创建了肌原纤维蛋白质表面疏水性的测定方法。疏水作用是维持蛋白三级结构的主导作用力之一,对蛋白质结构的稳定和功能性质具有重要作用。蛋白凝胶网络结构是蛋白分子之间以及蛋白分子与溶剂水分子之间作用力平衡的结果。一定的疏水性对于蛋白凝胶的形成和产生稳定的乳化物非常重要。
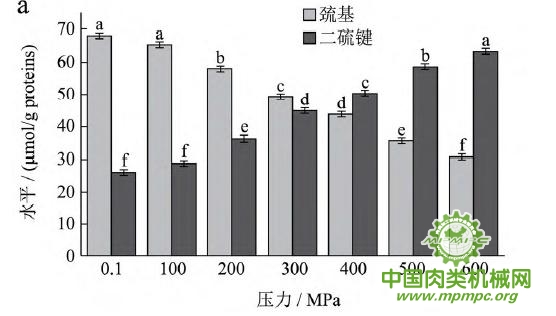
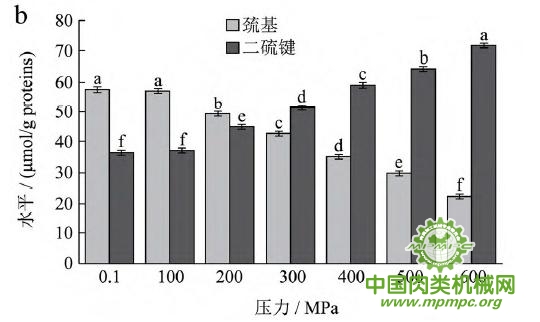
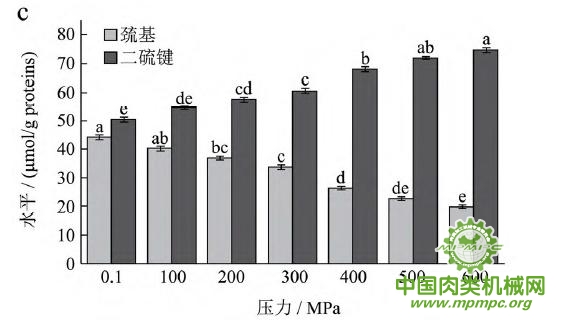
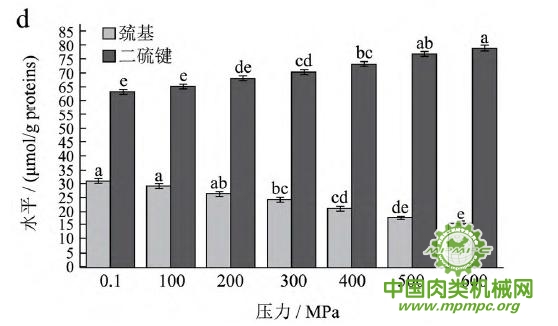
图2 超高压结合热处理对巯基和二硫键的影响
注:相同指标标注不同字母者具有极显著性差异,p<0.01;a~d 分别代表25℃、35℃、45℃和55℃温度处理条件下,巯基和二硫键含量对压力增加的变化规律。
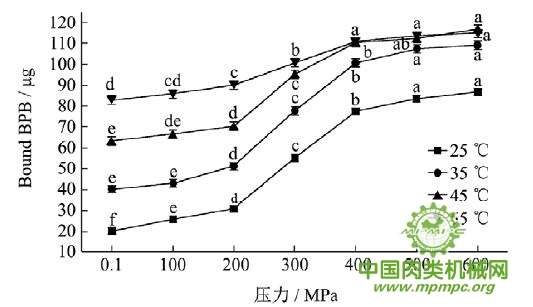
图3 超高压结合热处理对猪肉肌原纤维蛋白疏水性的影响
注:同一条曲线标注不同字母者具有极显著性差异,p<0.01。
从图3可以看出,随着压力和温度增加,猪肉肌原纤维蛋白疏水性逐渐增加,当压力大于200MPa时,疏水性极显著增大(p<0.01)。压力会导致肌原纤维蛋白解折叠,从而使疏水残基从蛋白质内部暴露出来,同时,压力还会诱导蛋白质表面特殊氨基酸残基的出现,导致疏水性增加。热作用也会导致表面疏水性的极显著增加(p<0.01)。Chelh 等研究结果表明肌原纤维蛋白的表面疏水性与加热时间和温度显著相关。
2.4 超高压结合热处理对猪肉肌原纤维蛋白氧化的影响
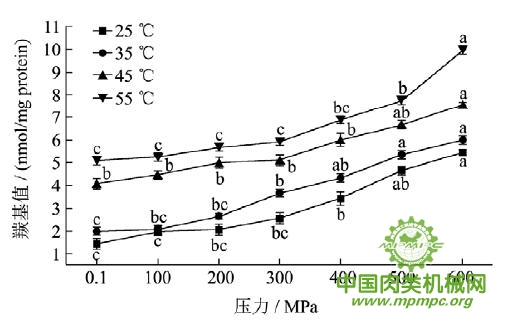
图4 超高压结合热处理对猪肉肌原纤维蛋白羰基值的影响
注:同一条曲线标注不同字母具有极显著性差异,p<0.01。
超高压结合热处理过程中猪肉肌原纤维蛋白羰基值的变化如图4所示。随着压力和温度的升高,羰基值极显著增大(p<0.01),从25℃0.1 MPa时的1.432nmol/mg 蛋白增加到55℃600 MPa时的9.965nmol/mg 蛋白。Sato和Hegaryt认为,任何能引起肉类肌纤维膜系统破坏的处理过程,如绞碎、加热、高压等,都能导致易氧化的成分曝露于氧气中,从而加速氧化过程。在高压结合热处理过程中,蛋白质结构发生变化,肌球蛋白、肌动蛋白及大部分肌浆蛋白变性,细胞膜结构被破坏,造成铁及其它过渡金属离子的释放,一些亚铁血红素、过渡态的金属离子和各种氧化酶可能会作为产生活性氧(ROS)和非氧自由基的催化剂或者作为前体物质。这些自由基会攻击蛋白质,对蛋白质氧化起到很强的催化作用,导致蛋白质羰基值升高。Estévez 等研究发现在法兰克福香肠冷藏过程中蛋白质羰基值与脂质氧化的羰基值显著相关,相关系数达到0.75(p<0.01)。猪肉在超高压结合热处理过程中脂质氧化程度增加,这可能是造成蛋白质氧化的原因之一。
2.5 超高压结合热处理对猪肉肌原纤维蛋白二级结构的影响
酞胺Ⅰ带的特征吸收峰位于1700cm-1-1600cm-1,是由蛋白多肽骨架的C=O 伸缩振动引起的,为蛋白质二级结构变化的敏感区域,且其吸收最强,常被用于蛋白质的二级结构分析。
超高压结合热处理后肌原纤维蛋白红外光谱图进行基线校正和9点平滑后,发现肌原纤维蛋白酰胺Ⅰ带是由多个氨基酸残基经重叠形成的宽峰,因此,需对各样品的酰胺Ⅰ谱带(1700~1600 cm-1)用软件进行求二阶导数及去卷积,对得到的各子峰进行确认,经Peakfit 对曲线进行拟合,多次拟合使残差最小。根据峰面积计算各二级结构的比率。各子峰与二级结构对应关系为:1600~1640 cm-1 为β-折叠;1640~1650cm-1为无规卷曲;1650~1660 cm-1为α-螺旋;1660~1695cm-1 为β-转角。
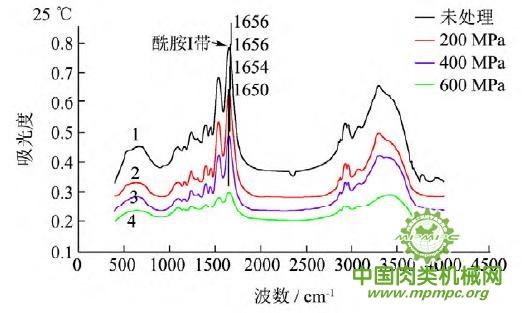
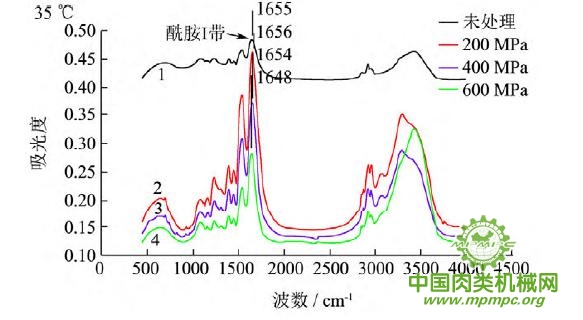
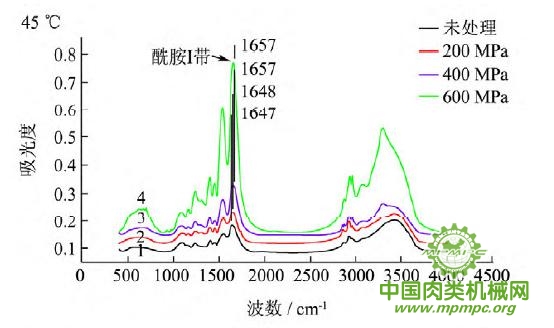
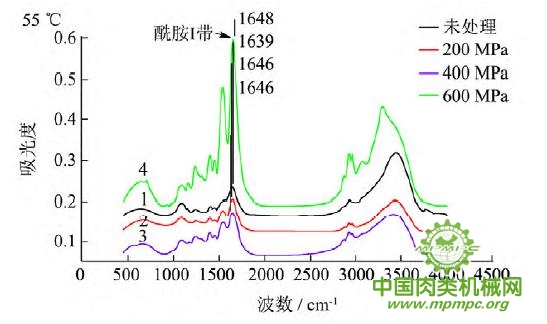
图5 超高压结合热处理后猪肉肌原纤维蛋白红外图谱
超高压结合热处理条件下,猪肉肌原纤维蛋白红外原始图谱如图5所示,由上到下依次为25~55℃。随着处理压力和温度的增加,肌原纤维蛋白氨基酸残基总吸光度发生了变化,峰形发生了不同程度的改变,说明蛋白质二级结构发生了变化。25℃下,随着压力的增大,酰胺Ⅰ带的吸收峰由1656 cm-1 移动到1650cm-1;35℃下,增大压力,酰胺Ⅰ带的吸收峰由1655cm-1 升高到1656 cm-1 最后又降低到1648cm-1 此处是无规卷曲的特征吸收峰;45℃下,随着压力的升高,酰胺Ⅰ带的吸收峰由1647cm-1向高波数移动到1657cm-1,此处是α螺旋的特征吸收峰;55℃下,酰胺Ⅰ带的吸收峰由1648cm-1 移动到1639cm-1,此处是β折叠的特征吸收峰,随后又随着压力的增大移动到1648cm-1。同样,随着温度的不断升高,酰胺Ⅰ带的吸收峰也发生了不同程度的位移。
为了将肌原纤维蛋白酰胺Ⅰ带的差异放大,提高光谱的分辨率,对其进行了二阶导数求导,重叠峰和小肩峰被明显分离,总峰数在9~12个之间,符合处理规则。观察各种处理的每个峰带,发现蛋白质结构有明显的变化。波数出现红移或者蓝移,或者出现新峰。
表1 超高压结合热处理过程中肌原纤维蛋白二级结构含量(%)变化
| 处 理 | β折叠/% | 无规卷曲/% | a螺旋/% | Β转角/% |
| 25°C 未处理 200MPa 400MPa 600MPa |
38.58±0.34a 36.27±0.45ab 34.42±0.27b 29.76±0.12c |
15.69±0.09a 17.48±0.13a 17.38±0.24a 22.54±0.47b |
15.85±0.25a 16.93±0.07a 16.86±0.19a 22.16±0.22b |
29.89±0.13a 29.31±0.16a 31.34±0.33a 25.54±0.32b |
| 35°C 未处理 200MPa 400MPa 600MPa |
39.49±0.59a 38.81±0.31a 35.72±0.29b 28.46±0.23c |
14.41±0.06a 14.33±0.22a 17.30±0.36b 30.64±0.20c |
14.12±0.28a 13.65±0.14a 16.78±0.29a 14.86±0.31a |
31.97±0.55a 33.21±0.39a 30.20±0.12a 25.54±0.32b |
| 45°C 未处理 200MPa 400MPa 600MPa |
42.47±0.11a 39.41±0.23b 36.35±0.17c 34.87±0.04c |
16.33±0.22a 15.83±0.29a 16.53±0.29a 17.36±0.33a |
14.97±0.51a 15.43±0.35a 16.68±0.19a 16.97±0.59a |
26.23±0.05a 29.33±0.09b 30.44±0.03c 30.79±0.44c |
| 55°C 未处理 200MPa 400MPa 600MPa |
44.72±0.34a 39.66±0.28b 39.46±0.44b 29.88±0.51c |
19.17±0.19a 14.76±0.03b 15.42±0.55b 24.92±0.39c |
14.76±0.09a 12.95±0.37a 15.59±0.21a 13.31±0.30a |
21.36±0.38a 32.63±0.42b 29.53±0.47c 31.85±0.03d |
注:同列中同一温度标注不同字母者具有极显著性差异,p<0.01。
曲线拟合结果如表1所示,未处理肌原纤维蛋白结构主要以β折叠为主,占38.58%,其他三类分别为α螺旋15.85%,β转角29.89%和无规卷曲15.69%。胡飞华采用傅里叶红外光谱分析超高压对梅鱼鱼糜肌原纤维蛋白二级结构的影响,发现肌原纤维蛋白的二级结构主要是以β 折叠为主。25℃下,随着处理压力的升高,β折叠含量极显著下降(p<0.01),无规卷曲含量极显著上升(p<0.01)。α螺旋在600MPa 时极显著增大(p<0.01),β转角随着处理压力的增加逐渐增大,400 MPa 达到最大值,随后极显著降低(p<0.01)。35℃时,β折叠与无规卷曲含量变化与25℃相似,α螺旋未发生明显变化,β转角也呈现出先升高再降低的趋势。45℃处理下,随着压力的增大,β折叠极显著降低(p<0.01),无规卷曲和α螺旋含量缓慢增大,β转角含量极显著上升(p<0.01),由26.23%增加到30.79%。55℃下,β折叠和α螺旋含量下降,分别由44.72%和14.76%下降到29.88%和13.31%,无规卷曲和β转角含量极显著上升(p<0.01),分别由由19.17%和21.36%上升到24.92%和31.85%。此时,猪肉肌原纤维蛋白质二级结构发生重排,螺旋结构减少,无序结构增多,疏水结合和离子结合可能由于体积的减小被切断,分子链展开。同时,对比不同温度处理下,β折叠和α螺旋的含量不难发现,随着温度的升高,β折叠含量逐渐升高,α螺旋含量逐渐降低,说明加热促进肌原纤维蛋白的α螺旋向β折叠转换。α螺旋结构是通过分子内氢键维持的蛋白质分子内的有序排列。在加热条件下其含量降低说明加热导致维持α螺旋结构的氢键作用减弱,促进蛋白质分子展开;β折叠是通过分子间氢键维持的蛋白质分子间的有序排列,加热后其含量增加代表蛋白质分子间氢键作用增强,导致蛋白质分子间聚集程度增大。
2.6 相关性分析
表2 超高压和热处理与蛋白质相互作用力、蛋白质氧化、蛋白质结构之间的相关性
| 指标 | 静电相互作用 | 氢键 | 疏水相互作用 | 二硫键 | 巯基 | 疏水性 | 羰基值 | β 折叠 | 无规卷曲 | α 螺旋 | β 转角 |
| 温度 | -0.319 | -0.762** | 0.349 | 0.694** | -0.694** | 0.587** | 0.698** | 0.348 | -0.047 | -0.545* | -0.057 |
| 压力 | -0.915** | 0.493** | -0.786** | 0.681** | -0.681** | 0.748** | 0.675** | -0.859** | 0.617* | 0.396 | 0.09 |
| 静电相互作用 | 1 | -0.214 | 0.634** | -0.855** | 0.855** | -0.860** | -0.876** | 0.745** | -0.694** | -0.189 | 0.041 |
| 氢键 | 1 | -0.752** | -0.26 | 0.26 | -0.119 | -0.194 | -0.725** | 0.28 | 0.481 | 0.314 | |
| 疏水相互作用 | 1 | -0.27 | 0.27 | -0.411* | -0.262 | 0.840** | -0.561* | -0.39 | -0.204 | ||
| 二硫键 | 1 | -1.000** | 0.966** | 0.951** | -0.361 | 0.47 | -0.004 | -0.143 | |||
| 巯基 | 1 | -0.966** | -0.951** | 0.361 | -0.47 | 0.004 | 0.143 | ||||
| 疏水性 | 1 | 0.902** | -0.406 | 0.443 | 0.064 | -0.087 | |||||
| 羰基值 | 1 | -0.404 | 0.481 | -0.056 | -0.058 | ||||||
| β 折叠 | 1 | -0.748** | -0.392 | -0.107 | |||||||
| 无规卷曲 | 1 | 0.143 | -0.444 | ||||||||
| α 螺旋 | 1 | -0.317 | |||||||||
| β 转角 | 1 |
注:*显著相关(P< 0.05);**极显著相关(p<0.01)。
由表2可知,温度与氢键和巯基含量呈极显著负相关(p<0.01),与二硫键、疏水性、羰基值呈极显著正相关(p<0.01),与α螺旋呈显著负相关(p<0.05),说明加热破坏了蛋白质二级结构,使氢键减小,蛋白质氧化,促进巯基与二硫键二者之间的转换,使疏水性上升,同时,破坏了分子内的有序排列,使蛋白质分子展开程度增加。压力与氢键、二硫键、疏水性、羰基值呈极显著正相关(p<0.01),与静电相互作用、疏水相互作用、巯基、β折叠呈极显著负相关(p<0.01),与无规卷曲呈显著正相关(p<0.05),说明与热处理相反的是压力可以稳定氢键,使巯基转换成二硫键,疏水性增大,羰基值增加,蛋白质凝胶结构趋于稳定,静电相互作用和疏水相互作用在压力的作用下被削弱,蛋白质有序结构减少,无序结构增多。还可以发现,蛋白质羰基值与静电相互作用和巯基呈极显著负相关(p<0.01),相关系数达到0.876 和0.951,与二硫键和疏水性呈极显著正相关(p<0.01),相关系数达到0.951和0.902,说明蛋白质氧化可以引起聚集和表面疏水性的变化,进而改变蛋白质的结构。静电相互作用力与β折叠呈极显著正相关与无规卷曲呈极显著负相关(p<0.01),氢键与β折叠呈极显著负相关(p<0.01),疏水相互作用力与β折叠呈极显著正相关(p<0.01),与无规卷曲呈显著负相关(p<0.05),说明随着蛋白质有序结构向无序结构的转变,静电相互作用和疏水相互作用力被削弱,氢键由于蛋白质的展开聚集和体积减小被加强。
3 结论
在超高压结合热处理猪肉过程中,随着压力和温度的升高,肌原纤维蛋白巯基含量极显著下降(p<0.01),二硫键含量极显著上升(p<0.01),疏水性和羰基值都极显著增大(p<0.01),高压结合热处理后稳定猪肉蛋白质的作用力主要是氢键、疏水性相互作用和二硫键。猪肉肌原纤维蛋白质二级结构在高压结合热处理过程中发生重排,螺旋结构减少,无序结构增多。从相关性分析的结果看,超高压结合热处理与蛋白质相互作用力、蛋白质羰基值、蛋白质结构之间存在着极显著的相关关系(p<0.01)。同时,蛋白质羰基值与静电相互作用和巯基呈极显著负相关(p<0.01 ),与二硫键和疏水性呈极显著正相关(p<0.01),说明蛋白质氧化可以引起聚集和表面疏水性的变化,进而改变蛋白质的结构。静电相互作用力和疏水相互作用力与β折叠呈极显著正相关与无规卷曲呈极显著和显著负相关(p<0.01)(p<0.05),氢键与β折叠呈极显著负相关(p<0.01),说明随着蛋白质有序结构向无序结构的转变,静电相互作用和疏水相互作用力被削弱,氢键由于蛋白质的展开聚集和体积减小被加强。








